
Biopsia tumoral y muestras de plasma
Para realizar con éxito una prueba de mutación del receptor del factor de crecimiento epidérmico (EGFR), se requiere una cantidad suficiente de células tumorales para garantizar que se extraiga una cantidad adecuada de ADN tumoral para el análisis.1–3 Los dos tipos de muestras principales utilizados para evaluar el estado de mutación de EGFR es una biopsia tumoral y muestras de ADN tumoral circulante (ctDNA) obtenidas de sangre (plasma).
Muestra de biopsia de tumor
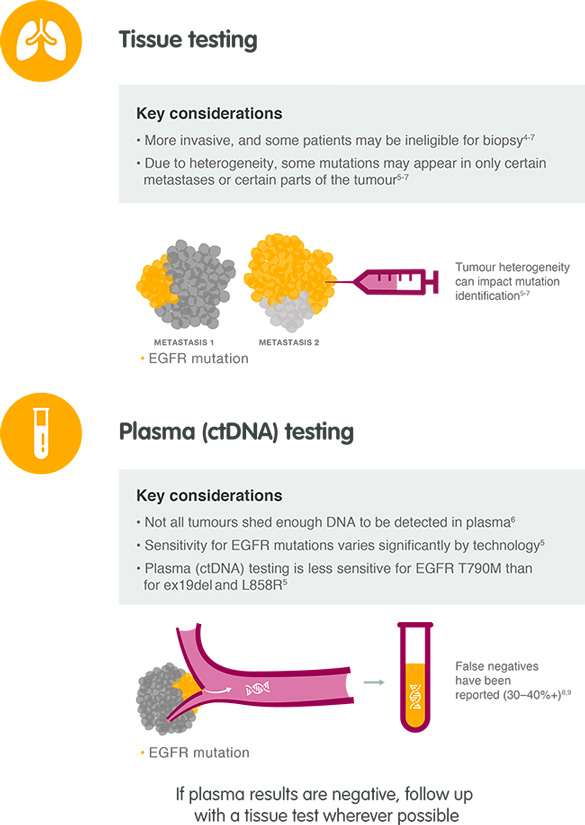
En el momento del diagnóstico de cáncer de pulmón de células no pequeñas (CPCNP) avanzado, una biopsia tumoral es el tipo de muestra preferido para evaluar el estado de mutación de EGFR. En caso de progresión de la enfermedad tras el tratamiento con un inhibidor de la tirosina quinasa (TKI) del EGFR, se recomienda una biopsia del tumor.10
Es importante que se sigan las pautas al obtener, fijar y manipular muestras de biopsias de tumores, y al realizar una prueba de mutación de EGFR:1,11,12
- Los laboratorios deben seguir buenas prácticas de laboratorio, estar completamente validados para realizar pruebas de mutación de EGFR e implementar esquemas de garantía de calidad.
- El sitio de la biopsia debe ser seleccionado por el médico que realizará la biopsia y, en general, la biopsia debe tomarse del sitio del tumor o metástasis más apropiado o de fácil acceso.
- Se pueden usar varias técnicas de biopsia tumoral bien establecidas para obtener muestras tumorales de alta calidad: biopsia central con aguja, biopsia transbronquial, biopsia endobronquial, biopsia con aguja guiada por tomografía computarizada, mediastinoscopia, cirugía torácica asistida por video y toracotomía.
- Se recomienda que las muestras sean fijadas en formalina, incluidas en parafina o frescas, congeladas o fijadas con alcohol. El fijador óptimo es formalina tamponada neutra al 10% y el tiempo de fijación debe ser de 6 a 12 horas para muestras pequeñas y de 8 a 18 horas para muestras quirúrgicas más grandes.
- Se debe determinar el contenido de células cancerosas y la cantidad y calidad de ADN de las muestras, y establecer la proporción mínima y el número de células cancerosas necesarias para la detección de mutaciones durante la validación.
Muestras de ctDNA (plasma)
En muchos pacientes con NSCLC avanzado, el ctDNA está presente en la sangre.13 En el diagnóstico primario de NSCLC avanzado, cuando no se dispone de una biopsia del tumor, el ctDNA de muestras de sangre (plasma) ofrece una alternativa para evaluar el estado de mutación de EGFR.
Según los resultados del estudio de fase IV IFUM, gefitinib fue el primer EGFR-TKI que permitió el uso de ctDNA (obtenido de una muestra de sangre) para evaluar el estado de mutación de EGFR en el momento del diagnóstico en aquellos pacientes en los que no se disponía de una muestra del tumor ( solo etiqueta de la UE).3,14
Después de la progresión de la enfermedad con un EGFR-TKI aprobado, puede ser más difícil obtener una biopsia del tumor que en el diagnóstico primario. Una muestra de ctDNA obtenida de sangre (plasma) ofrece una alternativa menos invasiva y potencialmente más rápida para las pruebas de mutación de EGFR.
El estudio de Fase II AURA2 evaluó la actividad y la seguridad del EGFR-TKI de tercera generación, osimertinib, en pacientes que habían progresado después del tratamiento con un EGFR-TKI aprobado. Este estudio apoyó la necesidad de la biopsia en el momento de la progresión de la enfermedad.15
Para las pruebas de ctDNA, para evitar la coagulación de la sangre y la lisis celular, se pueden usar tubos con EDTA si la muestra de sangre se va a procesar rápidamente; sin embargo, los tubos de recolección de estabilización brindan una alternativa cuando esto no es posible (p. ej., tubos de recolección de sangre Streck Cell-Free DNA). , tubos de recogida de ADN sin células de Roche, tubos PAXgene Blood ccf-DNA).16-18
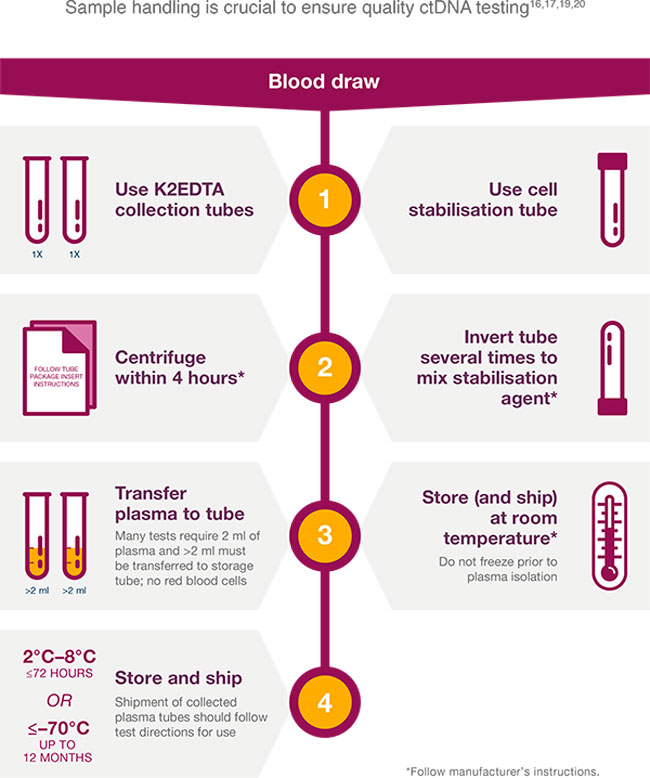
Tenga en cuenta: no se deben utilizar tubos de recogida de heparina, ya que esto puede interferir con las aplicaciones de PCR posteriores.21
Referencias:
- Pirker R et al. Consensus for EGFR mutation testing in non-small cell lung cancer: results from a European workshop. J Thorac Oncol 2010; 5: 1706–1713.
- Fujita S et al. Accuracy of epidermal growth factor receptor mutation analysis on the basis of small biopsy specimens in patients with nonsmall cell lung cancer. Int J Cancer 2006; 119(7): 1751–1752.
- Yu HA et al. Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers. Clin Cancer Res 2013; 19(8): 2240–2247.
- Oxnard GR et al. Association between plasma genotyping and outcomes of treatment with osimertinib (AZD9291) in advanced non–small-cell lung cancer. J Clin Oncol 2016; 34: 3375–3382.
- Thress KS et al. EGFR mutation detection in ctDNA from NSCLC patient plasma: Across-platform comparison of leading technologies to support the clinical development of AZD9291. Lung Cancer 2015; 90: 509–515.
- Schwaederle M et al. Detection rates of actionable mutations in diverse cancers using a biopsy-free (blood) circulating tumor cell DNA assay. Oncotarget 2016; 34: 3375–3382.
- Karlovich C et al. Assessment of EGFR mutation status in matched plasma and tumor tissue of NSCLC patients from a phase I study of rociletinib (CO-1686). Clin Cancer Res 2016; 22: 2386–2395.
- Thress KS, Brant R, Carr TH, et al. EGFR mutation detection in ctDNA from NSCLC patient plasma: Across-platform comparison of leading technologies to support the clinical development of AZD9291. Lung Cancer 2015; 90: 509-515
- Oxnard GR, Thress KS, Alden RS, et al. Association between plasma genotyping and outcomes of treatment with osimertinib (AZD9291) in advanced non–small-cell lung cancer. J Clin Oncol 2016; 34: 3375-3382.
- Novello S et al. Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016; 27 (suppl 5): v1–v27.
- Eberhard DA et al. Biomarkers of response to epidermal growth factor receptor inhibitors in Non-Small-Cell Lung Cancer Working Group: standardization for use in the clinical trial setting. J Clin Oncol 2008; 26: 983–994.
- Lindeman NI et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. Arch Pathol Lab Med 2013; 137: 828–860.
- Vallée A et al. Plasma is a better source of tumor-derived circulating cell-free DNA than serum for the detection of EGFR alterations in lung tumor patients. Lung Cancer 2013; 82: 373–374.
- Douillard J‐Y et al. Gefitinib treatment in EGFR mutated Caucasian NSCLC. Circulating‐free tumour DNA as a surrogate for determination of EGFR status. J Thorac Oncol 2014; 9: 1345–1353.
- Goss G et al. Osimertinib for pretreated EGFR Thr790Met-positive advanced non-small-cell lung cancer (AURA2): a multicentre, open-label, single-arm, phase 2 study. Lancet Oncol 2016; 17(12): 1643–1652.
- Streck cell-free DNA BCT instructions for use. Available at: https://www.streck.com/resources/Cell_Stabilization/Cell-Free_DNA_BCT/01_Instructions_(IFU)/01_IFU_Cell-Free_DNA_BCT_IFU.pdf. Accessed 03 March 2017.
- PAXgene Blood DNA System brochure. Available at: http://www.bd.com/resource.aspx?IDX=30495. Accessed 03 March 2017.
- Roche Cell-Free DNA collection tubes. Available at: http://sequencing.roche.com/en/products-solutions/by-category/sample-collection/cell-free-dna-collection-tube.html. Accessed 07 November 2017.
- cobas® EGFR Mutation Test v2 [package insert]. Indianapolis, IN: Roche Molecular Systems, Inc. 2016.
- Roche Cell-Free DNA Collection Tube, Instructions for Use. https://sftp.rch.cm//diagnostics/sequencing/literature/dna-collection/IFU_cfDNA_IVD_EN.pdf. Accessed 03 March 2017.
- El Messaoudi S et al. Circulating cell free DNA: preanalytical considerations. Clin Chim Acta 2013; 424: 222–230.
A CONTINUACIÓN
Precisión
Hay varias pruebas de mutación de EGFR diferentes y la elección de la prueba debe basarse principalmente en el tipo de muestra disponible. También se debe tener en cuenta la experiencia de laboratorio relevante y el equipo disponible.
Conozca más
