Precisión en las pruebas de mutación
Las mutaciones activadoras del receptor del factor de crecimiento epidérmico (EGFR) se encuentran en los exones 18 a 21 del gen EGFR, que es parte del gen que codifica el dominio tirosina quinasa de la proteína EGFR.1,2 En pacientes diagnosticados con enfermedad de células no pequeñas avanzada cáncer de pulmón (NSCLC), las mutaciones de EGFR más comunes son las deleciones del exón 19 y una mutación puntual L858R en el exón 21.3–7
Mutaciones primarias de EGFR2,8,9
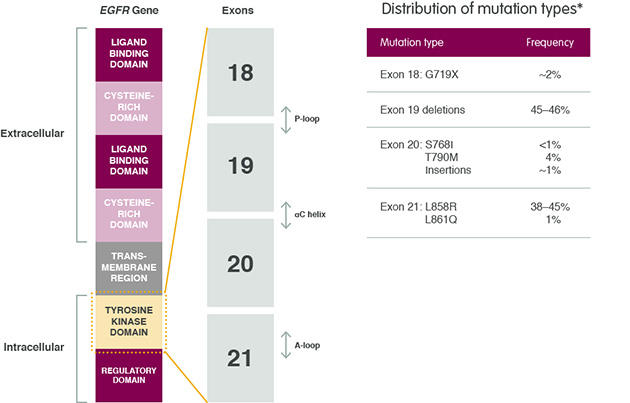
*Las mutaciones de EGFR y su frecuencia se basan en anotaciones COSMIC, algunas de las cuales pueden verse en el mismo tumor. Debido a que muchas entradas de datos en COSMIC reflejan estudios enfocados en los exones 21 y 19, la frecuencia de mutaciones más raras puede estar subestimada.2
Se sabe que existen otras mutaciones de EGFR poco comunes.8
G719X se refiere a G719A, G719C, G719S
Hay varias pruebas de mutación de EGFR diferentes y la elección de la prueba debe basarse principalmente en el tipo de muestra disponible. También se debe tener en cuenta la experiencia de laboratorio relevante y el equipo disponible.
Tecnologías de prueba
La elección del método de prueba de mutación de EGFR a menudo está influenciada por la experiencia del laboratorio y el equipo disponible. Los laboratorios pueden usar kits disponibles comercialmente, desarrollar sus propias pruebas (pruebas desarrolladas en laboratorio) o enviar las muestras a un laboratorio de pruebas especializado externo. Es importante considerar el uso de métodos de prueba altamente sensibles para muestras de citología y plasma debido al número limitado de células tumorales presentes en dichas muestras.10-12
Para garantizar que el proceso de prueba de mutación de EGFR sea confiable y consistente, y para garantizar que se caracterice cualquier mutación impulsora, es esencial incorporar garantía de calidad en cada paso del procedimiento. Esto incluye: 13
- Control de calidad independiente de datos e informes.
- Validación de nuevos ensayos
- Uso de buenas prácticas de laboratorio, incluido el control de la contaminación del producto PCR
- Uso de controles positivos y negativos.
Kits de prueba de mutación de EGFR
Pruebas disponibles comercialmente
Hay una serie de kits de prueba disponibles comercialmente para determinar el estado de mutación de EGFR; sin embargo, no todos los kits son diagnósticos in vitro (IVD) aprobados por las normativas. La aprobación reglamentaria se adopta a nivel regional y proporciona garantía de la integridad de la metodología de una prueba y, en algunos casos, de la utilidad clínica. En los EE. UU., la Administración de Alimentos y Medicamentos regula los IVD (indicados por una marca US-IVD) y en Europa esto se rige por la Directiva europea IVD (98/79/EC), indicada por una marca CE-IVD.
La siguiente tabla contiene ejemplos de kits de prueba de mutación de EGFR aprobados por las autoridades y disponibles en el mercado. Cuando corresponda, se indica el estado normativo de IVD para la UE y los EE. UU. Para conocer el estado regulatorio de IVD en otras regiones, consulte las pautas regulatorias locales.
Varios otros kits de mutación de EGFR están disponibles comercialmente, pero es posible que no cuenten con la aprobación reglamentaria, a menudo denominados kits de uso exclusivo para investigación. Los ejemplos incluyen EntroGen EGFR Mutation Analysis Kit para PCR en tiempo real, Sysmex OncoBEAM EGFR e Illumina TruSight Tumor 26.20-22
Pruebas desarrolladas en laboratorio
Las pruebas de mutación del receptor del factor de crecimiento epidérmico (EGFR) desarrolladas en laboratorio pueden ser menos costosas, pero su desarrollo y validación puede llevar tiempo.23 El control de calidad puede ser limitado en comparación con los kits preparados comercialmente, cuya reproducibilidad probablemente se haya probado antes distribución comercial.23 Las pruebas desarrolladas en laboratorio solo pueden someterse a control de calidad en un solo laboratorio, lo que significa que se desconoce la reproducibilidad de los resultados.
Referencias:
- Gazdar AF et al. Mutations and addiction to EGFR: the Achilles "heal" of lung cancers? Trends Mol Med 2004; 10: 481–486.
- Siegelin MD, Borczuk AC. Epidermal growth factor receptor mutations in lung adenocarcinoma. Lab Invest 2014; 94: 129–137.
- Mok TS et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361: 947–957.
- Yoshida K et al. Prospective validation for prediction of gefitinib sensitivity by epidermal growth factor receptor gene mutation in patients with non-small cell lung cancer. J Thorac Oncol 2007; 2: 22–28.
- Sequist LV et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31: 3327–3334.
- Wu YL et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 2014; 15: 213–222.
- Schuette W et al. EGFR mutation status and first-line treatment in patients with stage III/IV non-small cell lung cancer in Germany: an observational study. Cancer Epidemiol Biomarkers Prev 2015; 24: 1254–1261.
- Sharma SV et al. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer 2007; 7(3): 169–181.
- Shigematsu H et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers. J Natl Cancer Inst 2005; 97(5): 339–46.
- Pirker R et al. Consensus for EGFR mutation testing in non-small cell lung cancer: results from a European workshop. J Thorac Oncol 2010; 5: 1706–1713.
- Fujita S et al. Accuracy of epidermal growth factor receptor mutation analysis on the basis of small biopsy specimens in patients with nonsmall cell lung cancer. Int J Cancer 2006; 119(7): 1751–1752.
- Yu HA et al. Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers. Clin Cancer Res 2013; 19(8): 2240–2247.
- Public Health England. Good Laboratory Practice when Performing Molecular Amplification Assays. UK Standards for Microbiology Investigations. Q 4 Issue 4.4 (2013). Available at: https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/344076/Q_4i4.4.pdf. Accessed 14 March 2016.
- Aisner DL, Marshall CB. Molecular pathology of non-small cell lung cancer: a practical guide. Am J Clin Pathol 2012; 138: 332–346.
- cobas® EGFR Mutation Test v2 [package insert]. Indianapolis, IN: Roche Molecular Systems, Inc. 2016.
- Therascreen® EGFR RGQ PCR Kit Handbook: Version 2. August 2016. https://www.qiagen.com/ch/resources/resourcedetail?id=d217c9ca-b9f6-4891-8c46-32b71e83d88a&lang=en. Accessed 03 March 2017.
- AmoyDx® EGFR 29 Mutations Detection Kit. Version: B1.1. August 2013. Available at: http://www.mobitec.com/cms/products/bio/09_ivd/EGFR_Plasma_Testing.html?pdf=ADx-EG07-RG72.pdf. Accessed 03 March 2017.
- Panagene PNAClamp™ EGFR Mutation Detection Kit Instruction (ver 2) Manual: version 1.1. December 2013. Available at: https://secure.eurogentec.com/EGT/files/Panagene/TDS-PN-PNAC-3002.pdf. Accessed 03 March 2017.
- Therascreen® EGFR Pyro® Kit Handbook: Version 1. March 2015. Available at: https://www.qiagen.com/gb/resources/resourcedetail?id=94c89f69-54f1-43d7-ba5a-2393df515b1e&lang=en. Accessed 03 March 2017.
- EntroGen Inc. EGFR Mutation Analysis Kit for Real-Time PCR. Available from: http://entrogen.com/web3/egfr-mutation-analysis-kit/. Accessed 27 January 2017.
- Sysmex Inostics GmbH. BEAMing digital PCR Technology. Available from: http://www.sysmex-inostics.com/fileadmin/media/f121/Fact_sheets/Sysmex_Inostics_BEAMing_Digital_PCR_Technology_en.pdf. Accessed 27 January 2017.
- Illumina®. TruSight Tumor 26. Available from: https://www.illumina.com/products/by-type/clinical-research-products/trusight-tumor-26-gene.html. Accessed 28 April 2017.
- Ellison G et al. EGFR mutation testing in lung cancer: a review of available methods and their use for analysis of tumour tissue and cytology samples. J Clin Pathol 2013; 66(2): 79–89.
A CONTINUACIÓN
Resultados de la prueba
Los datos de mutación de EGFR deben informarse utilizando las Recomendaciones de la Sociedad de Variación del Genoma Humano. Esto asegura que los resultados de la prueba de mutación de EGFR puedan ser entendidos e interpretados por el médico tratante para permitir que se tomen decisiones de tratamiento precisas.
Conozca más

